Histopatologické vyšetření
Při odběru vzorků je třeba uvážit odkud, v jakém rozsahu a kolik vzorků odebrat.
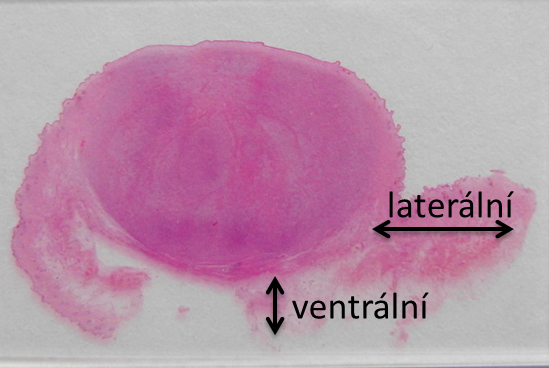
Je-li požadováno posouzení kompletnosti excize, je třeba zaslat celou exstirpovanou tkáň, ideálně s označením okrajů stehem (např. dorsální okraj jeden steh, ventrální okraj dva stehy atd.). Nemá-li vzorek označené okraje, popisuji okraje v rovinách řezu:
K odběru kožních bioptátů použijte punch (průbojník) velikosti 0,5 cm v průměru. ODBĚR PROVÁDĚJTE PŘEDEVŠÍM Z CENTRA LÉZE! Při celotělových změnách je vhodné zaslat k vyšetření alespoň 3 biopsie z různých míst. Srst nad místem odběru biopsie by měla být opatrně ostříhána nůžkami (bez použití holicího strojku). Není vhodné používat dezinfekční prostředky, díky kterým mohou vznikat artefakty. K lokální anestezii před odběrem je možné použít 2% mesocain podaný subkutánně. S odebraným bioptátem je nutné zacházet opatrně, aby nedošlo k jeho zmáčknutí pinzetou (vždy uchopovat za podkožní část).
K odběru transmurálních bioptátů střeva a žaludku je rovněž vhodné použít punch. Při laparotomii se standardně odebírá fundus, pylorus, duodenum, jejunum a kolon. U koček se mimo GI biopsií odebírá také vzorek z pankreatu a jater (k vyloučení triaditidy).
Při odběru gastrointestinálních endoskopických biopsií se standardně odebírá fundus, pylorus, duodenum a kolon. Při tomto vyšetření lze dignostikovat pouze změny probíhající ve sliznici. Endoskopická biopsie není vhodná k diagnostice karcinomu žaludku/střeva a pochopitelně dalších procesů probíhajících pod sliznicí. Při odběru je nutné endoskopické klíšťky zabořit hluboko do sliznice. Endoskopické bioptáty se zasílají na filtračním papíře v histologické kazetě:
Varlata se zasílají k vyšetření celá. Při bilaterální orchiektomii je vhodné zaslat obě varlata včetně nadvarlat a semenných provazců. Varle je možné podélně naříznout pro usnadnění fixace.
Oční bulby se zasílají k vyšetření kompletní.
Mízní uzliny: Ideální je zasílat celou mízní uzlinu nebo velkou klínovou biopsii obsahující kůru i dřeň. Na žádanku vždy uvádějte velikost mízních uzlin v centimetrech.
Často se vyšetřují nádory mléčné žlázy u fen, kdy se současně v jedné mléčné liště, a někdy i jednom vemínku, vyskytuje několik nádorů a každý může být jiného typu. V tomto případě je doporučeno odebrat vzorky ze všech těchto nádorů. Lze zaslat celou mléčnou lištu, viz zasílání velkých vzorků.
Odebraný vzorek jen nutné fixovat a tím zastavit autolytické procesy. Existuje celá řada fixačních roztoků, ovšem nejvhodnější a univerzální je neutrální 10% roztok formalínu. V každé lékárně je možné zakoupit cca 38% roztok formaldehydu (Rp. Solutio formaldehydi conc.) a ten v poměru 1:9 zředit vodou z vodovodu. Skladujete-li formalín na klinice, je vhodné ho pufrovat (100 ml formalínu (37-40% stock solution) + 900ml vody + 4g/l NaH2PO4 (monobasický) + 6.5g/l Na2HPO4 (dibasický/anhydríd). Formaldehyd je vydáván pouze po předložení receptu podepsaného veterinárním lékařem. Poměr objemu fixačního roztoku ku objemu vzorku je ideálně 1:50, minimálně 1:30, tj. měří-li vzorek 1 cm3, měl by být minimálně ve 30 ml formalínu. Dalším důležitým krokem je výběr správné nádobky pro fixaci a zasílání vzorku. Nejvhodnější jsou plastové odběrovky se širokým hrdlem a dobře těsnícím víčkem.
Minimální doba fixace vzorku je 24 hodin v odpovídajícím objemu formalínu. Vzorek se odesílá k histopatologickému vyšetření se správně vyplněnou žádankou. Velmi důležitými údaji jsou druh, plemeno, věk a pohlaví zvířete spolu s popisem klinického projevu onemocnění. Zpracování vzorku v histopatologické laboratoři trvá 1-2 pracovní dny. Při zasílání kostních či kalcifikovaných tkání je třeba počítat s dekalcifikací, která trvá v závislosti na velikosti vzorku 3-14 dní.
Při zasílání velkých vzorků (např. celá slezina, velký nádor mléčné žlázy) je možné ponechat tkáň dva až pět dní fixovat ve velkém množství formalínu (např. ve sklenici o objemu 5 l) a poté zaslat zabalenou v gáze napuštěné formalínem v silnostěnném plastovém sáčku s pouze minimálním množstvím formalínu, kteý udržuje gázu vlhkou. Vzorek je možné před fixací na několika místech naříznout pro usnadnění prostupu formalínu do tkáně.
Hemangiosarkom sleziny je často obtížné diagnostikovat z drobných bioptátů. Tyto nádory jsou většinou velmi rozsáhlé, výrazně nekrotické a prokrvácené. Není-li možné zaslat celou slezinu, je vhodné odebrat několik vzorků menší velikosti z různých míst nádoru a z přechodu do makroskopicky nepostižené tkáně.
Cytologické vyšetření
FNAB (fine needle aspiration biopsy). Pro odběr použije
zelenou jehlu a 10 ml stříkačku, velikost stříkačky se neodvíjí od velikosti léze, ale od tlaku, který je nutný vytvořit pro odběr dostatečného množství materiálu. Jehlu zavádějte v několika směrech, vysunujte (pochopitelně ne úplně) a zasunujte pod různým úhlem na několika místech, aby byl vzorek representativní. Ihned po odběru rozetřete získaný materiál na 3 až 5 sklíček, podobně jako krevní nátěr nebo tzv.
"squash" technikou (na podložní sklo s odebraným materiálem položte další podložní sklo, jemně přitlačte k sobě a horní sklo jemně sesuňte po celé délce spodního sklíčka) a osušte, nelépe fénem (z větší vzdálenosti, aby se buňky nepoškodily vysokou teplotou).
Zasíláte-li podložní skla spolu se vzorky pro histopatologické vyšetření, nesmíte je dát do stejného obalu, neboť dojde k působení formalínu na cytologický preparát a vzniku formalínového artefaktu. Sklíčka zasílejte neobarvená, budou obarveny v laboratoři standardní technikou. Sklíčka jasně označte, nejlépe písmeny aby se dalo rozpoznat na které ploše jsou buňky.
Bronchoalveolární laváže a efuse. Ze získané tekutiny vyberte větší částice, které je možné squash technikou rozetřít na podložní sklo. Zbylou tekutinu poté centrifugujte při 2500 ot./min a ze sedimentu připravte cytologický preparát. Stěry z tracheálních kanyl rozetřete na podložní sklo a osušte - viz výše.
CSF. Nechte odkápnou první kapky CSF kontaminované krví. Část odebraného CSF centrifugujte na klinice a sediment rozetřete na podložní sklo klasickou squash metodou. Zbývající část CSF je možné do laboratoře zalsat v EDTA odběrovce. Chcete-li posoudit CSF při fokální míšní lézi, odeberte vzorek kaudálně za touto lézí, tedy z lumbální cisterny.
Všechny aspiráty s vysokým obsahem vody (moč, ascites atd.) je vhodné nejdříve centrifugovat a cytologickému vyšetření podstoupit získaný sediment. Nemá smysl posílat velkoobjemový výplach ke zpracování do laboratoře, neboť během transportu dojde k autolýze buněk a k multiplikaci případných bakterií, které vzorek kontaminovaly během odběru.
Článek o odběru vzorků publikovaný ve Veterinářství 2017